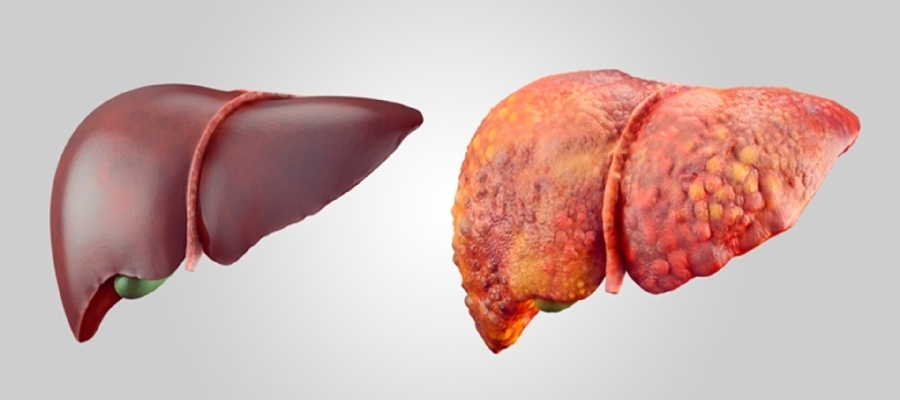
La enfermedad del hígado graso no alcohólico (EHGNA) es uno de los trastornos hepáticos más prevalentes en todo el mundo. La EHGNA es considerada una enfermedad multisistémica asociada con trastornos cardiometabólicos así como mortalidad por todas las causas y por trastornos cardiovasculares. El tratamiento de primera línea para el manejo de EHGNA es la modificación del estilo de vida.
Las intervenciones del estilo de vida, así como la modificación de la dieta y el ejercicio para alcanzar una pérdida de peso, son esenciales en el tratamiento de los pacientes con EHGNA. Se ha informado que una pérdida de peso de entre el 7% al 10% ayuda a mejorar la fibrosis hepática en pacientes con EHGNA. Sin embargo, en comparación con la nutrición o el ejercicio, los trastornos del sueño no han sido ampliamente investigados. De los numerosos trastornos del sueño, la apnea obstructiva del sueño y la corta duración del sueño se han señalado como factores de riesgo para EHGNA.
El sueño tiene un papel importante en la salud cardiovascular, sistema endocrino e inmune. Aproximadamente, un tercio de nuestra vida la pasamos durmiendo, sin embargo, hoy en día, por el ritmo de vida, la duración del sueño ha ido disminuyendo. Esta disminución podría afectar negativamente la sensibilidad a la insulina y la actividad inflamatoria, lo cual puede contribuir al desarrollo de EHGNA. Del mismo modo, se ha sugerido que una corta duración del sueño se asocia con obesidad, síndrome metabólico y enfermedad cardiovascular, las cuales también se pueden presentar en personas con EHGNA.
La relación entre la calidad del sueño y el desarrollo de EHGNA aún no está del todo clara. Estudios han demostrado que una corta duración del sueño incrementa el riesgo de desarrollar EHGNA. Por otro lado, otras investigaciones no han encontrado un vínculo entre el sueño y EHGNA.
Se han sugerido diversos mecanismos por los cuales el sueño puede contribuir al desarrollo de EHGNA. Una mala calidad del sueño tiene la capacidad de activar el eje hipotalámico-pituitario-suprarrenal, lo que mejora la activación de la secreción de hormonas del estrés como cortisol y catecolaminas, las cuales incrementan el riesgo de síndrome metabólico. Otros han demostrado la asociación entre un sueño deficiente y la orexina hipotalámica, la cual controla la secreción de leptina y grelina, encargadas de la regulación del apetito. Además, estas hormonas están involucradas en la regulación de la glucosa. Se ha informado que la mala calidad del sueño incrementa la resistencia a la insulina en pacientes con diabetes mellitus tipo II. La presencia de estrógenos activa la respuesta del eje hipotalámico-pitutario-suprarrenal al estrés y la resistencia a la insulina debido a la mala calidad del sueño, esto se desarrollo solo en mujeres; lo cual podría explicar la relación entre la calidad del sueño y EHGNA de acuerdo al sexo.
Si bien aun no existe información concluyente entre el riesgo de EHGNA y la calidad/duración del sueño, se ha encontrado que el sueño podría influir en el desarrollo de esta enfermedad. Es importante mantener una buena calidad del sueño ya que tener una mala calidad también se ha relacionado con la presencia de otras enfermedades y no solo EHGNA.
Equipo de investigación y editorial iNat México.
Referencias
Um, Y. J., Chang, Y., Jung, H. S., Cho, I. Y., Shin, J. H., Shin, H., Wild, S. H., Byrne, C. D., & Ryu, S. (2021). Sleep Duration, Sleep Quality, and the Development of Nonalcoholic Fatty Liver Disease: A Cohort Study. Clinical and translational gastroenterology, 12(10), e00417.
Takahashi, A., Anzai, Y., Kuroda, M., Kokubun, M., Kondo, Y., Ogata, T., Fujita, M., Hayashi, M., Imaizumi, H., Abe, K., Tanji, N., & Ohira, H. (2020). Effects of sleep quality on non-alcoholic fatty liver disease: a cross-sectional survey. BMJ open, 10(10), e039947.
Chou, Y. T., Cheng, H. J., Wu, J. S., Yang, Y. C., Chou, C. Y., Chang, C. J., & Lu, F. H. (2018). The association of sleep duration and sleep quality with non-alcoholic fatty liver disease in a Taiwanese population. Obesity research & clinical practice, 12(6), 500–505.
Comments are closed.